No.46
No.46

金属錯体の合成による抗がん剤の研究
多様ながんに有効な治療薬を目指して
新しい光線力学的療法と画像診断薬の開発
化学生命工学部
中井 美早紀 准教授
Misaki Nakai

近年における日本人の三大死亡原因はがん、心疾患、肺炎であり、3人に1人ががんにより死亡している。がんの克服は日本人のみならず、人類にとっての重要課題だが、現在使われている一般的な抗がん剤は副作用が強く、がんの種類によっては大きな効果が得られないと言われている。中井美早紀准教授は、金属錯体を用い、副作用が少なく、多様ながんに有効な治療薬の開発を目指す。
がん細胞を抑制する金属錯体
まず基本的な質問ですが、錯体とは?
金属が水溶液に溶けた状態を金属イオンといい、その周りに配位子といわれる分子やイオンが結合したものを錯体と呼びます。錯体の種類は無限にありますが、すべての金属錯体ががん治療に使えるわけではありません。基本的に、金属は生命にとって毒です。例えば、花瓶の水に10円玉を入れると切り花が長持ちします。これは金属がバクテリアの繁殖を抑えるため。「毒をもって毒を制す」の原理であり、薬剤にも同じ法則が適用されています。人間にとって毒となるものはがん細胞にとっても毒。つまり、抗がん作用があるのです。問題は、正常細胞にとっても毒であるため、副作用が出てしまうこと。それらを踏まえ、私たちは薬剤として使える金属錯体を選別し研究、開発しています。
現在、抗がん剤として広く用いられているのはシスプラチンですが、これはどのような錯体なのでしょう?
中心が白金の錯体で、配位子はアンミンと塩化物イオンです。水に溶かすと塩化物イオンが水イオンに置き換わり、DNAと結合してその立体構造をゆがませることでDNAの複製を妨げ、がん細胞を死滅させます。副作用として、主に脱毛、嘔吐などの症状が挙げられます。
安価で副作用の少ない光線力学的療法
中井先生が研究されている光線力学的療法とは?
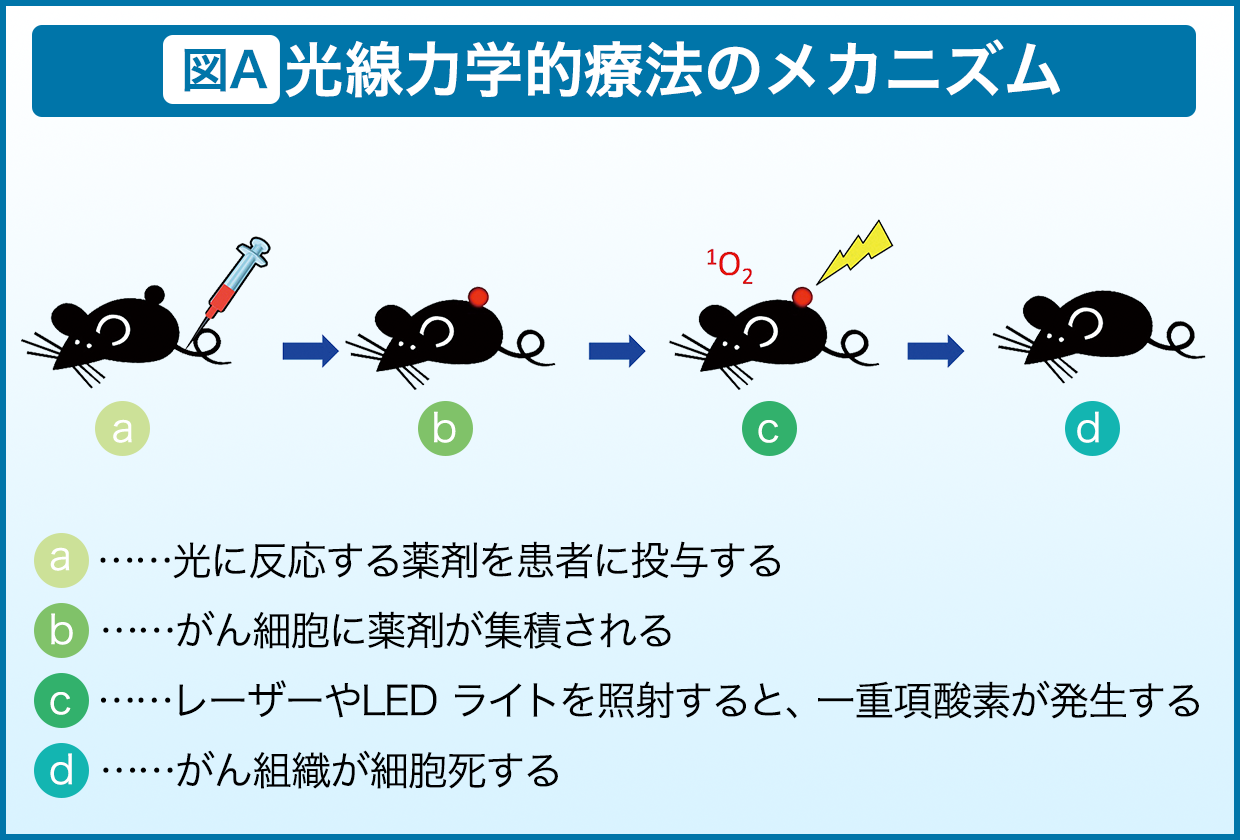
ルテニウムや亜鉛の錯体を用いた光に反応する薬剤を患者に投与し、がん細胞に薬剤が集積されたのを見計らって光を照射する療法です。これにより薬剤が活性化し周辺の溶存酸素にエネルギー移動を起こすと、溶存酸素は活性化されて活性酸素の一つである一重項酸素となります。活性酸素といえば悪いイメージがありますが、がん細胞に対しても非常に強い毒性を持っており、これがDNAを酸化し切断することで抗がん作用を示すのです(図A)。この療法は、既に緑内障や皮膚がんの臨床に応用されており、膀胱がんへの応用も検討されています。
この療法のメリットとは?
化学療法だと薬剤が全身に届き、特に腎臓や肝臓に集積され、そこに毒性がかかりますが、光線力学的療法では光を照射した箇所だけが毒性を生み出すので、他の場所には影響がありません。また、レーザーやLEDライトを使用するため、放射線治療のように大がかりな装置も必要とせず、低費用で治療できます。特に亜鉛は安価で入手することができ、さらに、金属イオンを挿入することで活性酸素発生能が向上するといった効果も見られます。
先生が行われている、さらに一歩進んだ研究とは?
現状、光線力学的療法の臨床ではポルフィリン化合物を用いていますが、私たちはこれに代わる、より効果の高い化合物の開発を進めています。ポルフィリンは光、特に可視光を多く吸収するうえ、体内で十分な安定性を示し、修飾(合成)しやすいという特性を持っています。しかし、深部のがんにはなかなか良い効果を示さないため、光の種類や波長を変え、さらに吸収しやすい化合物を探索しているのです。今は、培養したがん細胞を使っての実験段階ですが、これがうまくいけば、次はマウスでの試験となります。
また、ポルフィリンは水溶性に乏しく、体内から排出されるのに時間がかかるという難点もあります。薬剤が体内に残っているうちに日光に当たると、全身に活性酸素による症状が出てしまうため、投与された患者は一定期間、暗所で安静にしていなくてはならないのです。これまで私たちは抗がん薬として糖質を導入した亜鉛錯体の開発を行ってきました。糖質を連結させると水溶性が向上し、薬剤が全身に回りやすくなり、代謝も早まります。この技術を光線力学的療法にも応用できないかを検討しています。
さらにポルフィリンに糖質を連結させると、水溶性の向上だけでなく、がん細胞のみに取り込まれやすくなります。がん細胞は増殖するスピードが非常に速く、その分他の細胞よりも多く養分を集める特性があります。その養分の一つが糖質。つまり、がん細胞が糖質を集める癖を活用するというわけです。
画像診断薬としての糖連結ポルフィリン剤
がんの画像診断薬に糖質を導入する研究もされているとか。
ポルフィリン誘導体は、がんの画像診断薬としての応用も広く研究されています。例えば、アミノレブリン酸は代謝されると、ポルフィリン誘導体が合成されます。がん細胞は生成したポルフィリン誘導体を代謝することができないため、光を照射するとその部分だけが光ります。本来がんは、その疑いがある箇所すべてを切除したいところですが、脳などの場合はそういうわけにはいきません。ポルフィリンを用いた画像診断薬は、MRI等の大型機器を使用したり病理検査をしたりしなくても、その場ですぐにがん細胞を特定できます。ハンディーで治療の初期費用が抑えられることもメリットです。このようにポルフィリン誘導体は光線力学的療法のみならず、画像診断薬にも応用でき、がんの早期発見・早期治療にとって非常に魅力的な物質の一つです。
実際のがん細胞への応用に向けて
今後の展望をお聞かせ下さい。
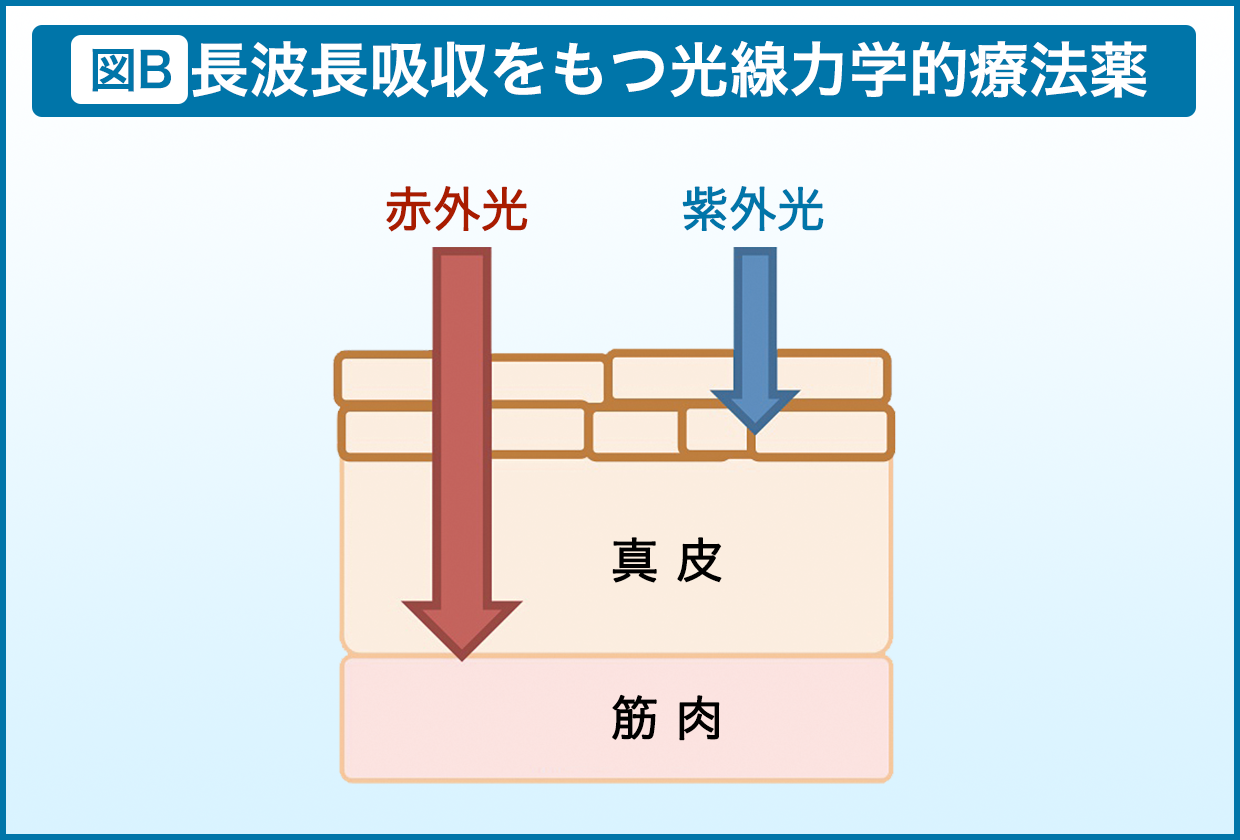
現在いくつかの研究を進めていますが、中でも注力したい研究が二つあります。一つは、光を用いてできる限り生体内の恒常性を乱さない抗がん剤を開発すること。深部のがんにも対応できるよう、皮膚透過性が良い赤外光に着目し、赤外領域に大きな吸収帯を持つ金属ポルフィリンを探求しています。赤外光に近づけば近づくほどその物質の持つ励起エネルギー準位は低くなり、活性酸素の効率が良くないので、その兼ね合いが非常に難しいところですね。
既にこの研究はマウスを用いて実験する段階まで進んでいますので、臨床まで持っていき、実際のがん細胞に応用したいと思っています(図B)。
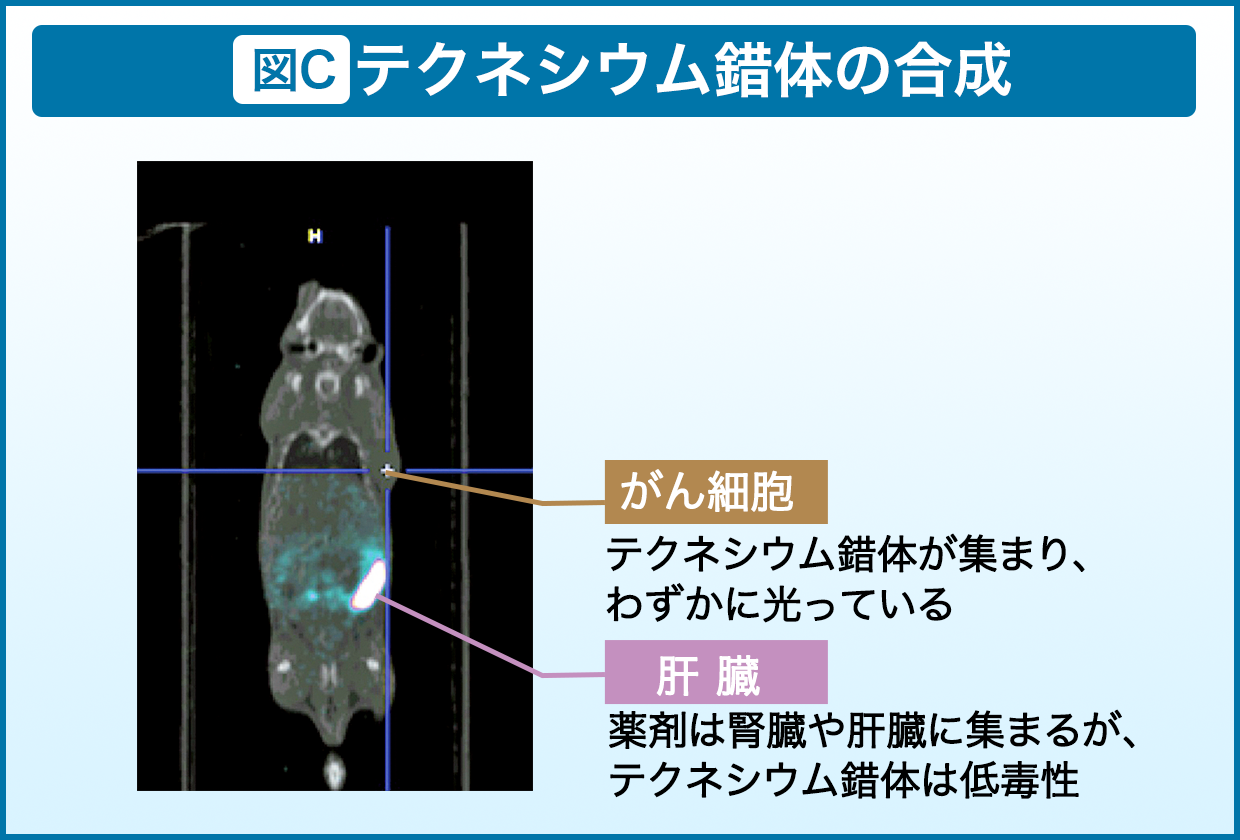
もう一つは、がん悪性化の原因の一つであるがん幹細胞の診断薬を開発すること。こちらは一昨年の9月より1年間、カナダのサイモンフレーザー大学へ赴き、共同研究を進めてきました。多くの悪性がん細胞は低酸素状態にあるのですが、酸素のないところでは光線力学的療法は使えません。しかも、低酸素状態は時間によって変化するため、リアルタイムで診断する必要があります。そこで低酸素状態のがんを特定して狙える放射性元素・テクネシウムの錯体を開発中であり、こちらもマウスを用いた実験を行っています(図C)。まだ、がんに光が集まっているはっきりとした画像は撮れていませんが、今後はもっと鮮明に確認できるようになります。