バイオマテリアルのフロンティアを切り拓く --社会実装を見据え、多様なバイオマテリアルを開発--
奥野陽太(化学生命工学部 化学・物質工学科 助教)
(2024年10月11日)

バイオマテリアルは生体に使用される材料のことで、主に医療分野で活用されています。材料科学の最先端の知見を生かした新たなバイオマテリアルが次々と登場し、今や先端医療技術の大きな柱になっています。
KUMPの奥野陽太助教は、基礎研究で培った技術を駆使して、さまざまなバイオマテリアルを開発しています。創薬モダリティ(*1)が多様化する今、アカデミアの知見を社会に役立てるためにはどうしたらよいのでしょうか。研究への思いや今後の展望について、奥野助教に伺いました。
*1 抗体医薬、細胞治療、遺伝子治療など、創薬の基盤となる技術によって分類した医薬品の種別のこと
Contents
化学の魅力は、新しいものを生み出せること
----研究者を志したきっかけは何ですか。
明確に一つのきっかけがあったわけではないのですが、小学生くらいの頃から、ものごとの背後にある仕組みを解き明かすことに興味がありました。捨てられた機械を拾ってきて分解したり、子ども向けの科学実験のイベントに参加したりするのがすごく楽しかったので、そういう原体験があったのかなと思います。
----もともと研究者向きの性格だったんですね。化学を専攻したのはなぜですか。
最初から化学者になりたいと思っていたわけではなくて、理系分野全般に興味がありました。ですが、中学生の頃、病気で入院したときに投薬を受けたら嘘のようにすぐ治ったことに感動して、薬学部を志望するようになりました。
しかし、高校で学びを深めるうちに、新しい薬の開発だけでなく、もっと広く工業分野に応用できる化学にどんどん惹かれていって、大学では化学を専攻しました。
化学は実際に物質を生み出せることが、私にとって大きな魅力でした。実際にものを作り出して、機能やその背後にあるメカニズムに迫るというアプローチが、自分の性に合っていたんだと思います。
社会に役立つ材料を作りたい。バイオマテリアル研究の道へ
----奥野先生は大学時代から一貫してバイオマテリアルの研究開発をされていますが、この分野の魅力は何ですか。
個人的な病気の経験もありますし、人の役に立つということは、私にとって大きな魅力です。純粋に学術的な興味としても、求める機能や物性を持つ物質を実際に構築することに、 関心を持ちました。こうして振り返ってみると、バイオマテリアルの道に進んだのは、自分としては自然な流れだったのかなと思います。
----学生時代はどんな研究をされていましたか。
「ペプトイド」と呼ばれるペプチドを模倣した物質を扱っていました。ペプチドは複数のアミノ酸が結合したもので、抗体医薬品と低分子医薬品の中間くらいの分子量を持っています。そのため、ペプチドを医薬品として応用することで、両者の「いいとこどり」できると期待されています。私が当時やっていたのは基礎的な研究でしたが、最初から応用を意識していました。
大学院では、ペプトイドを基盤とした新規材料の設計を行い、分子透過性を有するベシクルや、特定の細胞を選択的に除去できるフィルタなどの開発などを行いました。現在はさらに研究の射程を広げ、ペプトイドに限らず、社会実装を見据えた多様なバイオマテリアルの開発を行なっています。
複数の酵素を内包できるゲル微粒子、医療・食品分野に応用可能
----現在、力を入れている研究について教えてください。
私たちのチームが開発している材料の中で最も社会実装が近いと期待しているのが、酵素を内包できるゲル微粒子です。酵素は、消化や代謝など体の中で起こるさまざまな化学反応の触媒となる物質で、先天的な酵素の欠損や酵素のはたらきの低下により、さまざまな病気が引き起こされます。そういった病気に対しては酵素を補う治療が必要ですが、酵素は温度やpHの変化などで容易に失活してしまうことが難点です。
そこで、酵素を保護する手法として、酵素をゲル微粒子内に包み込む「酵素内包ゲル微粒子」が検討されてきました。しかし、従来の酵素内包ゲル微粒子の作製手法では、有機溶媒を使用することが一般的です。そのため、酵素失活や残存溶媒による毒性の懸念があります。
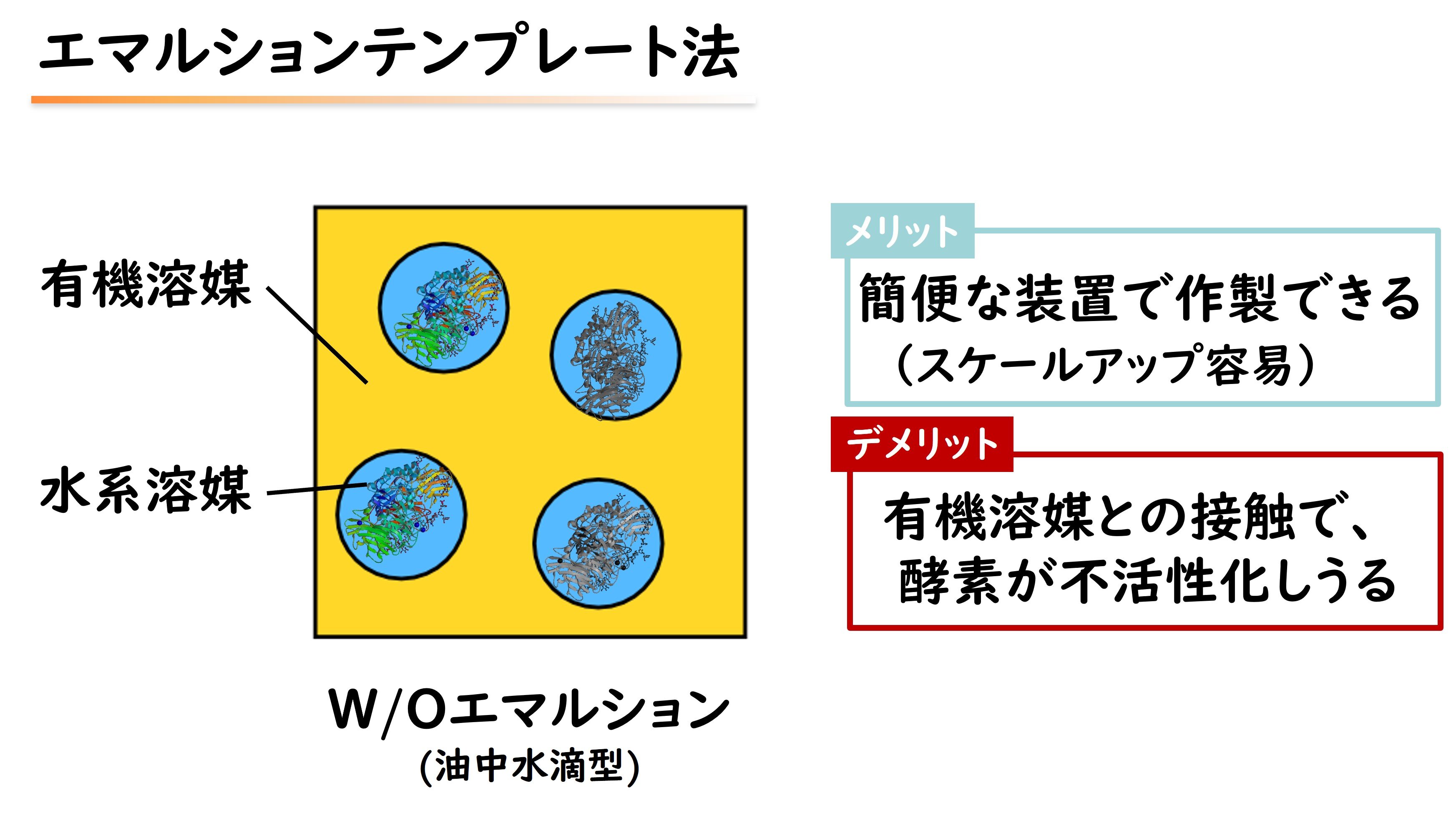
図 エマルションテンプレート法(従来の酵素内包ゲルの作成法)
エマルションとは、お互いに混ざり合わない二種類の液体を混ぜ合わせた結果、一方の液体が微粒子となって他方の液体中に分散している状態のことを指します。水性エマルションテンプレート法では、まず、生体適合性ポリマーであるポリビニルピロリドン(PVP)と魚由来のゼラチンを混ぜ合わせます。すると、魚由来ゼラチンの微粒子が自発的に形成されてエマルションとなります。
この技術の核は、このエマルションに「後から」酵素を添加すると、自発的に微粒子の内部に取り込まれることです。これにより、毒性の懸念のない酵素内包ゲル微粒子を簡便かつ効率よく作ることができます。
酵素を内包したゲル微粒子は、以下のステップでマイクロ反応場として機能します。
- 酵素を内包したゲル微粒子を、その酵素に対応する基質が溶解した水溶液中に分散させる。
- ゲル網目を通して基質が微粒子内に取り込まれ、酵素によって生成された化合物を水中に吐き出すマイクロ反応場として機能する(酵素はゲルの中にとどまり続けるので、何度も使用が可能)。
- 複数酵素を内包したゲル微粒子の場合、体内における物質生成過程と同様に、ゲル微粒子の内部で複数の酵素反応を連続して行うことができる。
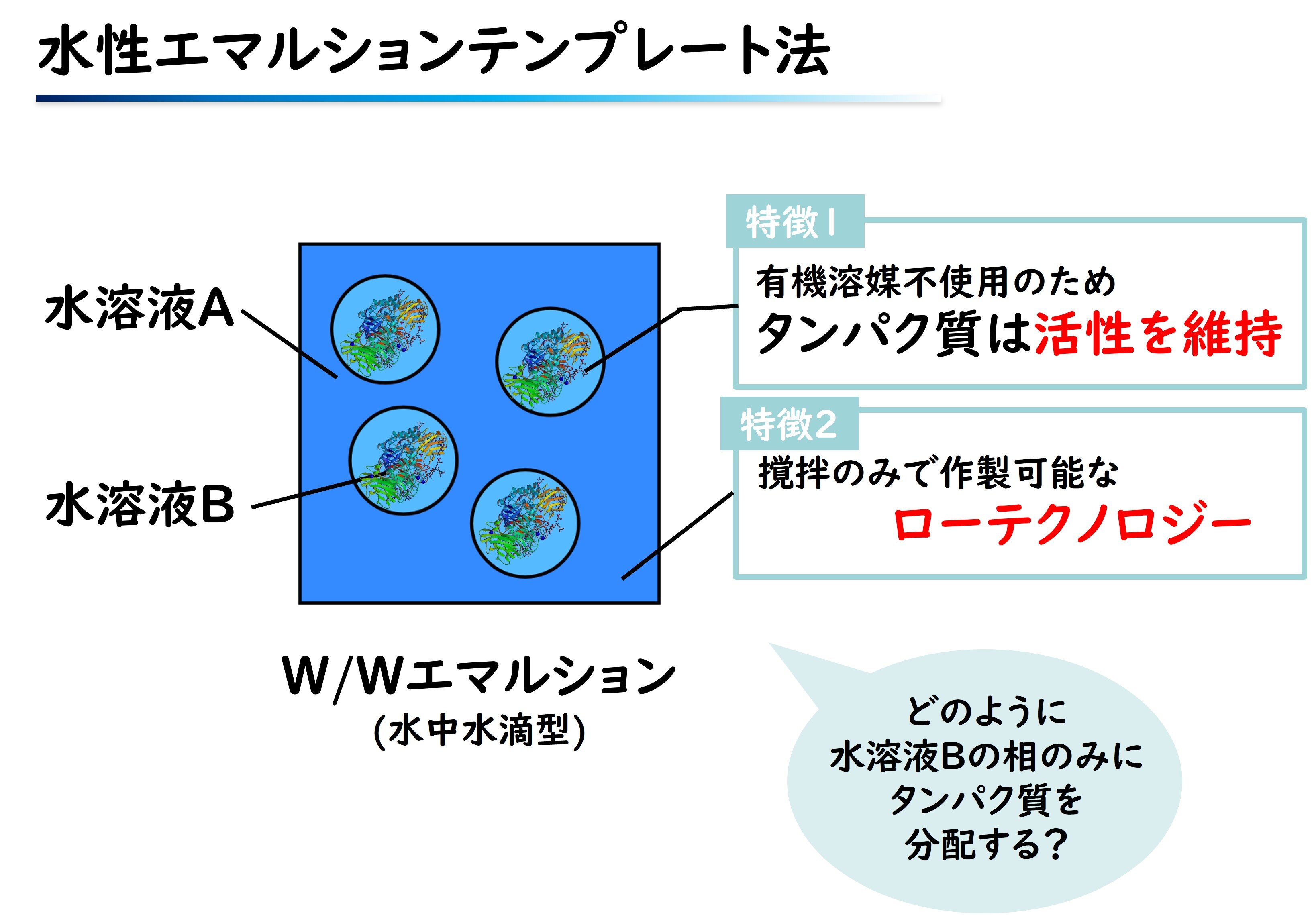
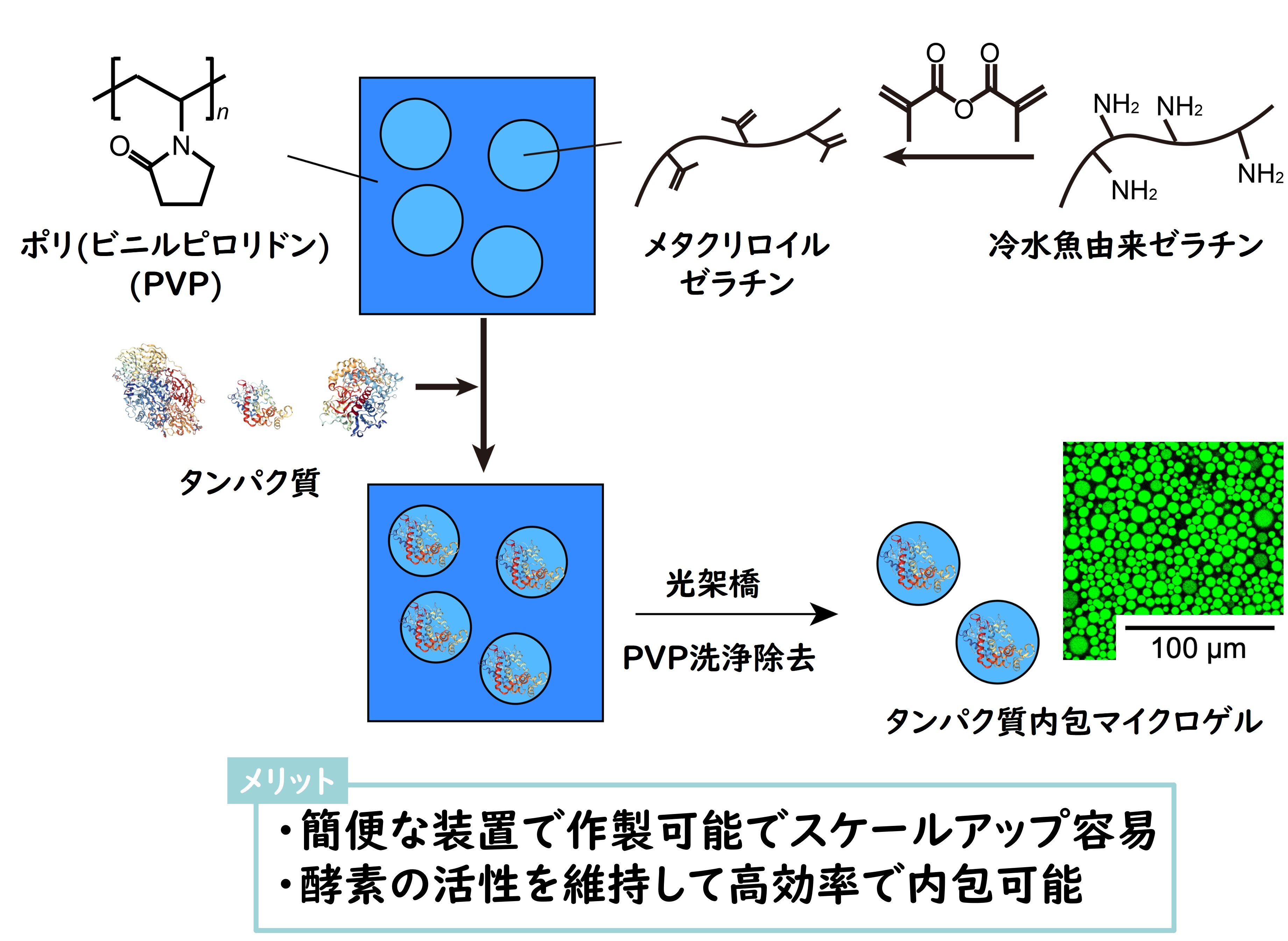
図 水性エマルションテンプレート法
水性エマルジョンテンプレート法で作成した酵素内包ゲル微粒子は、酵素が失活するような条件の水溶液中でも安定的に化学反応を行うことができます。ゲル微粒子の作成方法を調整することによって、酵素反応が進む速度を制御することも可能です。さらに材料を工夫すれば、外部刺激による反応速度の制御なども可能になるでしょう。
これはドラッグデリバリーシステム(DSS)への応用を念頭に開発した技術ですが、さまざまな酵素に適用可能な方法ですので、DDSなどのメディカル分野、香粧品分野のみならず、 プロバイオティクスなどの食品分野や、水中の有害物質分解などの環境分野への応用も期待できると思います。
タンパク質を良好に保持できるコアセルベート、ナノサイズでの安定化も可能
----ゲル微粒子のほかには、どのような研究に取り組んでいますか。
もう一つの軸は「コアセルベート」です。コアセルベートとは水溶液の液-液相分離(2種類の水溶液が濃度の違いによって水と油のように分離する現象)によって生じる、濃厚な高分子水溶液の液滴のことを指します。コアセルベート内部には、酵素を含むさまざまな生体分子を内包可能であることから、創薬分野などでの応用が期待されています。
ですが実のところ、私自身のコアセルベートへの興味は、もっと基礎的な部分にあります。コアセルベートはカチオン性高分子とアニオン性高分子とのイオン結合によって生じる単純コアセルベートと、エラスチンなどの生体の中にあるようなタンパク質が凝集体を作る複合コアセルベートに大きく分けられています。
しかし、いずれのコアセルベートも、静電相互作用や疎水性相互作用など、共有結合よりもはるかにエネルギーの小さな非共有結合的な相互作用が核となるという点で共通しています。私が今考えているのは、この単純な二分法を超えてコアセルベートをもっと包括的に捉えられないだろうかということです。そうした視点でコアセルベートに向き合うことで、革新的な技術開発につながるのではという予感がしています。
----具体的には、どういう課題の解決を目指していますか。
医療応用に向けたコアセルベートの大きな課題としては、生体環境内での不安定性、凝集しやすさ(コロイド安定性の低さ)などが挙げられます。私たちは、既存に発想にとらわれずさまざまな相互作用をコアセルベート生成に活用することで、これらの課題を解決できるのではと考えています。
たとえば私たちはこれまでに、ポリサルコシンと呼ばれる水溶性高分子の末端に少しの糖鎖をつけることで、水素結合によって駆動するコアセルベートを作製しました。まだ検討中ですが、生体環境内で機能性の向上につながると期待されます。
また、トランスファーソームと呼ばれる従来技術を組み合わせることで、ナノサイズでコアセルベートを安定化させることにも成功しています。トランスファーソームとは、非常に柔軟性の高いリポソームのことで、塗り薬や目薬など、既存のソフトマテリアルよりもさらにソフトな材料が求められる分野での応用が期待されています。我々が開発したトランスファーソームに被覆されたコアセルベートを「トランスファーソーム」と名付けていますが、この技術をさらに発展させることで、タンパク質を高効率でナノサイズに内包し、経皮透過させることも、将来的には可能になるかも知れません。

社会実装実現の鍵は、アカデミアと企業の相互連携
----開発された技術の社会実装に向け、どんな課題がありますか。
私自身、実は企業でも働いた経験があり、アカデミアだけでなく企業の目線も持つことの重要性を肌で感じました。
大学や公的研究機関は、概念的なものを形にする基礎研究が得意です。私はそこにより魅力を感じて、アカデミアに戻りました。また、私にとって嬉しい誤算だったのは、学生との協働も非常に刺激的だったことです。自分が撒いた種を学生が育てて、予想もできなかった成果が出ることもしばしばあり、そこは大学の大きな魅力だと感じました。とてもやりがいを感じています。
一方、企業はアカデミアが生み出した要素技術をニーズに合わせて最適化・スケールアップすることが得意です。それぞれの強みを活かして連携することで、初めて社会実装が実現すると思いますので、これからも積極的に連携していきたいです。
たとえば、先ほど述べた酵素内包ゲル微粒子は、すでにニーズにあわせた最適化の領域に到達していると思いますので、すぐにでも連携に取り組めます。一方、コアセルベートは微粒子ゲルよりはまだ基礎的な段階ですが、だからこそ、より大きな可能性がひらけているという期待もあります。ですので、私たちの技術に興味がある方はお気軽にご連絡いただけると嬉しいです。
一人の研究者としても、共同研究をすることによって、違う視点を知ることができ、成長につながっていると感じています。自分では想像もしなかったような方向に研究が進んでいくのも、共同研究の醍醐味ではないでしょうか。
(文:椿玲未)
プロフィール
名前 奥野陽太(化学生命工学部 化学・物質工学科 助教)
2022年京都大学大学院工学研究科高分子化学専攻博士後期課程修了。博士(工学)。合成した生体関連高分子を用いて、様々さまざまな機能を有する分子の領域を創出することが興味対象。一度企業で研究職を経験しているため、その視点も活かして新しい材料の創出を目指している。



