 No.11
No.11

金属錯体とDNAの相互作用を研究
副作用のない制がん剤を目指す
ルテニウム錯体の制がん作用を追究し、新しい光化学療法剤開発へ
化学生命工学部 化学・物質工学科
中林 安雄 教授
Yasuo Nakabayashi
制がん剤を用いる化学療法は、外科手術、放射線療法と並ぶがんの 3 大治療法の一つですが、副作用などの問題があり、決定的な治療法になっていません。日本人の 3 人に 1 人ががんで死に至る時代を迎え、サイエンスの力を結集した効果的ながん治療法の開発が待望されています。化学生命工学部の中林安雄教授は、金属錯体とDNAとの相互作用を研究し、錯体化学の領域から新しい制がん剤への応用に取り組んでいます。
DNA合成を阻害し、がん細胞を抑制
まず基本的なことですが、錯体とは?
金属イオンの周りに配位子と呼ばれる分子やイオンが結合した一群のものを、一般に錯体(complex)といいます。例えば、銅イオンの周りにいろんなものが規則正しく結合しますが、決まった数しか結合できません。また血液の中のヘモグロビンは、酸素を運ぶ重要な部分が鉄の錯体となっています。ですから鉄分が不足すると貧血になるのです。
多くの金属錯体は特有の色を持っています。これは可視光を吸収するということで、光のエネルギーを蓄える物質と考えることもできます。また、錯体は化学反応を制御・促進させる触媒として用いられています。錯体の領域は広く、無機化学と有機化学の両方にわたっています。
代表的な制がん剤であるシスプラチンは、どのような錯体なのですか。
シスプラチンは白金の錯体です。非常に強力な抗腫瘍活性を示し、激しい腎毒性、吐き気、難聴などの副作用があるにもかかわらず、世界中で広くがんの治療に用いられています。特に欧米では、最も高頻度に使用されている制がん剤の一つです。わが国でも1983年に制がん剤として認可を受けて以来、従来の制がん剤の投与では治癒することが不可能とされていた多くの種類の固形がんに対して鋭い切れ味を発揮しています。
シスプラチンが制がん剤として作用する原理は?
細胞内でのシスプラチンのターゲットがDNAであることは、培養細胞でのDNA、RNA、タンパク質の合成速度を比較することによって分かります。DNA合成のみが阻害されます。DNAの複製を阻害することで、がん細胞の増殖を抑え、制がん効果へとつながるのです。すなわち、白金ががん細胞のDNAに結合することにより、DNAの修復機能を妨げて、それ以上増殖しないという原理です。
ルテニウム錯体がDNAを選択的に結合
問題は、効果があっても副作用があるということですね。
そうです。シスプラチンのデメリットは副作用が非常に大きいことに加えて、耐性ができてしまうことです。最初は効くのですが、そのうちにだんだん効かなくなってきます。そこで、われわれは副作用のない、新しい制がん剤を作ろうと、実験を重ねているところです。
どのような方法を用いて、がんを抑えるのですか。
白金以外の金属を使ってもできるのではないかと考えて、ルテニウムを使用しています。大きく分けて二つの方法があります。一つは基本的にシスプラチンと同じような原理ですが、シスプラチンは白金一つで、DNAと結合する形が決まっていて選択性がありません。一方、複核ルテニウム錯体を用いて、ルテニウムとルテニウムの間を架橋する配位子にいろいろ使ってやれば、いろんなところでDNAが結合する可能性があります。ジアミン類で架橋した複核ルテニウム錯体は、DNAのグアニン塩基のみに選択的に結合することが分かりました。ルテニウムとルテニウムの距離に応じて、どこに結合するかということも解明できると思います。
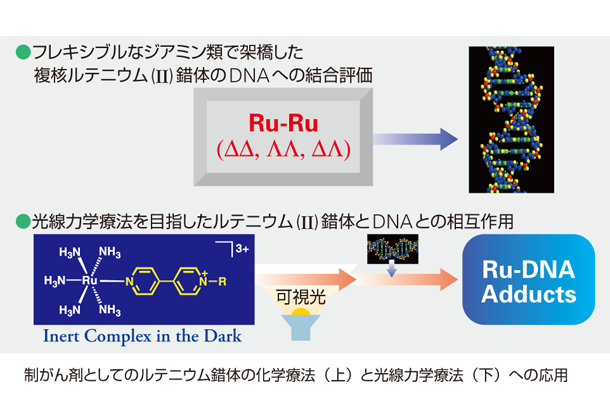
制がん剤としてのルテニウム錯体の化学療法(上)と光線力学療法(下)への応用
酸素に依存しない光化学療法剤を開発
もう一つの方法は?
錯体がDNAに近づき、そこに光など別のエネルギーが当たることによって、DNA自身を切断し、がん細胞をつぶしてしまう方法です。先に説明した光を用いない方法は、がん細胞に届くまでに正常な細胞に対しても作用してしまう可能性がありますが、後者は光を当てなければ何も反応しないので、正常な細胞を傷つけることはなく、副作用の点から非常に有望です。これは「光線力学療法」といわれる方法で、われわれはさらに一歩進めた方法を考えています。
それは現在の光線力学療法とどこが違いますか。
光線力学療法は、レーザー光と腫瘍親和性を有する光感受性物質により、腫瘍細胞のみを選択的に壊死させる治療法です。現在の光線力学療法は、錯体に光を当てて活性化し、錯体と酸素が反応して発生した活性酸素がDNAを切断するという原理です。われわれが使っている錯体は、その作用のほかに、光を当てて錯体自身を分解することによって、それがDNAに結合し、制がん作用を出そうというものです。
その目的は、酸素に依存しない光化学療法剤の開発です。多くの悪性のがん細胞は低酸素状態にあり、酸素の必要性は欠点になるからです。酸素のないところに光線力学療法は使えず、活性酸素を発生させられません。酸素があってもなくても、光を当てると錯体自身が分解してDNAに結合するような化合物ができれば、どんな条件でもがんに効くと考えられています。

実際のがん細胞に使用する応用段階へ
今までの成果と今後の展開について。
国立がんセンターでヒト培養がん細胞を使ってスクリーニングをしてもらった結果、炭素が四つつながっているルテニウム錯体は、今までにないような作用を持つ物質であると期待されるという結果が得られました。それを使って、さらに研究を進めていきます。
また、酸素に依存しない光化学療法剤の開発の方は、光照射で配位子の脱離が起こり、錯体を分解させてDNAに結合させ、がん細胞がそれ以上修復できなくなるという効果が期待できます。
われわれの錯体に制がん作用があり、DNAにアタックしてDNAを切断するということは分かっています。次は実際にそれをがん細胞に使って、どこまで効くのかというところまでやってみようと考えています。

